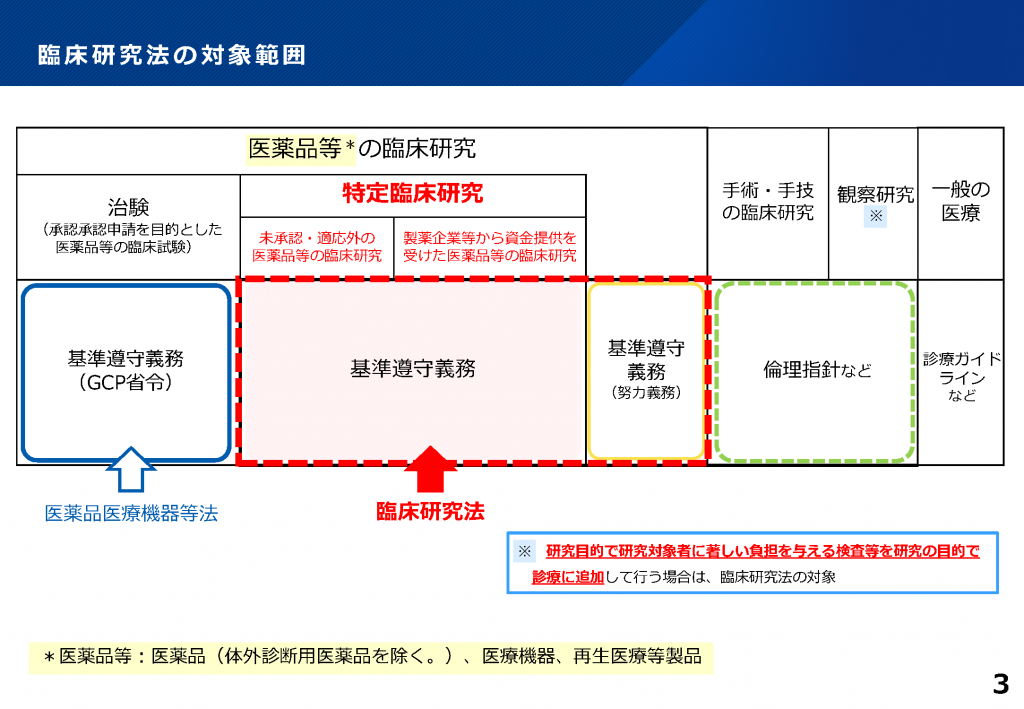
特定臨床研究とは
「臨床研究法(平成29年法律第16号)」において、以下に該当する臨床研究は
「特定臨床研究」と定義され、法規制の対象となります。
・医薬品医療機器等法における未承認・適用外の医薬品等の臨床研究
・製薬企業等から資金提供を受けて実施される医薬品等の臨床研究
出典:厚生労働省ホームページ
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000163417.html
(厚生労働省「臨床研究法の改正概要(説明資料)ページ3」
https://www.mhlw.go.jp/content/10800000/001506521.pdf)
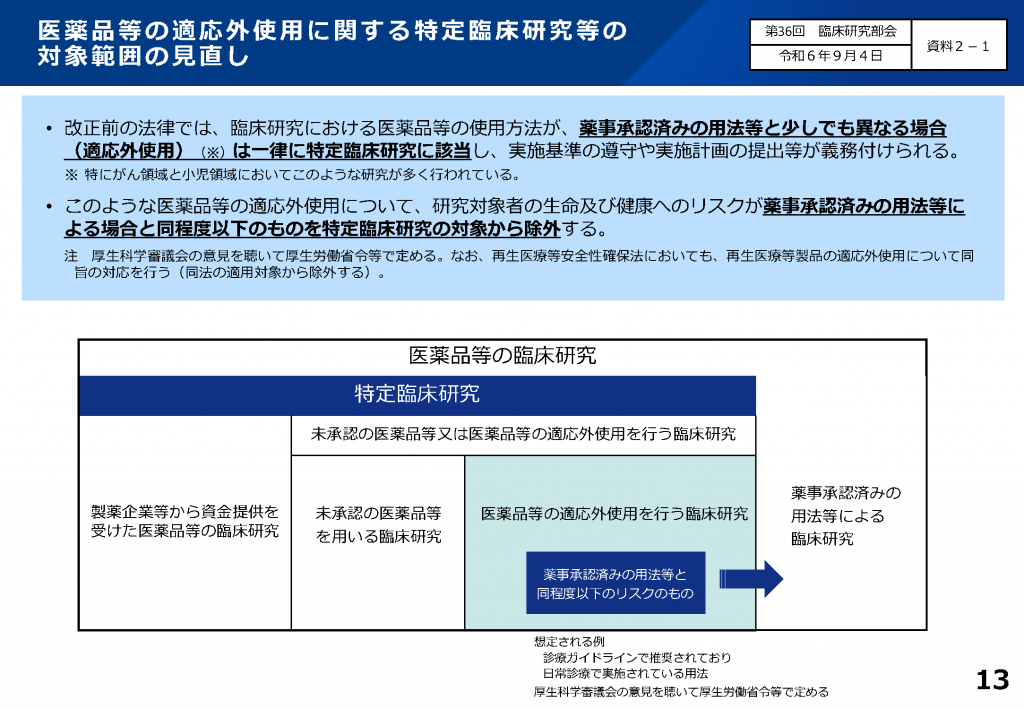
出典:厚生労働省ホームページhttps://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000163417.html
(厚生労働省「臨床研究法の改正概要(説明資料)ページ13」https://www.mhlw.go.jp/content/10800000/001506521.pdf)
特定臨床研究の審査
臨床研究法に該当する「特定臨床研究」の審査は、厚生労働大臣の認定を受けた認定臨床研究審査委員会「学校法人日本医科大学臨床研究審査委員会」で行われています。
学校法人日本医科大学臨床研究審査委員会のページはこちら
認定臨床研究審査委員会の承認後は、「臨床研究等提出・公開システム(jRCT)」を通して厚生労働省へ届出が行われ、広く一般に公開されます。